在A-Level化学第六章节初始,我们会接触到一个概念叫“焓”(Enthalpy),它指的是一份物质所具有的能量,用焓=内能+压强*体积来表示。然而对于焓的理解是比较抽象的,但理解焓的差值“焓变”就容易多了。
很多化学反应,在反应前后会有温度变化,例如木炭燃烧、硝酸铵结冰等。这就代表了吸热或放热反应中的能量得失。这部分能量我们就称之为“焓变”。
例如我们在室外燃烧一小块炭生成CO2放出10kJ热量,那么这部分能量就用∆H来表示,代表燃烧过程中逸散到空气中的热量。反应产生的能量变化可以是不同形式的,包括热量、光、体积变化等等,但这些能量的变化,我们都可以称之为“焓变”。
焓变也有不同的形式,例如反应焓、形成焓、燃烧焓、中和焓和原子化焓等,这些焓有些是可以实际测量的,也有些是我们为了计算而虚构的,实际反应可能并不存在。
那么在引入了焓的概念以及各类焓的定义之后,就来看看他在我们的题目里是怎么应用的吧。在此之前,我们需要理解Hess’s Law是如何运用的。

对于一个化学反应,总能量变化是一定的,无论经过几步反应,或者经过什么反应路径,甚至是虚构的中间步骤。类似于物理或者数学中的向量,无论你经过几个(连续的)步骤,只要起点和终点是相同的,向量和也就相同。
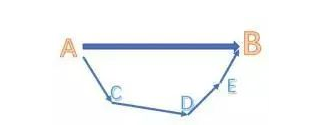
(从图中就能很直观的看出)
下面我们做一道题来尝试一下吧!(题目如下)

在此题中,我们无法直接求得由C4H10的燃烧焓,那么我们就需要走一个弯路,寻求反应物和生成物之间的一个共同终点站B,也就是C、H2和氧气分别形成它们的形成焓∆fHƟ。尽管并不可能用碳粉和氢气氧气来制成丁烷,但在原子数上,ABC确实都保持了平衡,那么这个循环就是成立的。我们来画出一个焓变示意图。
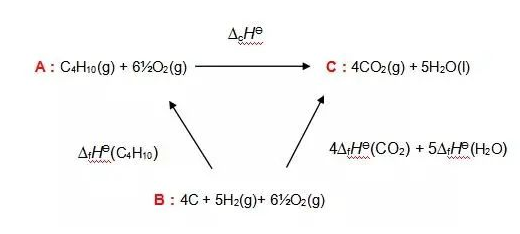
由C、H2、O2形成C4H10的能量是C4H10的形成焓∆fHƟ(C4H10),同时等量的O2可以约去;另一边,同样由C、H2、O2形成CO2和H2O的能量是四份∆fHƟ(CO2)和五份∆fHƟ(H2O)。那么,我们求A→C的焓,也就是求A→B→C的总焓。
值得注意的是,这里的∆fHƟ(C4H10)表示的反应方向是C→A,所以我们如果要表示A→B,需要取∆fHƟ(C4H10)的负值,所以∆fHƟ=-∆fHƟ(C4H10)+(4∆fHƟ(CO2)+5∆fHƟ(H2O))=-(-134.5)+(4*-393.5+5*-285.8)=2868.5 KJ mol-1,也就表明丁烷C4H10的燃烧焓为2868.5 KJ mol-1。
这道题算是一种简单的循环,更复杂的循环会涉及到多步反应和相变,在同学们刷题过程中,如果遇到也不要害怕。注意反应方向和保持元素平衡,即使是十几步反应,也能像拼图一样一步步完整起来。